Cela peut être lié à la structure plus lâche des micelles de caséine à un pH plus élevé, ce qui favorise l’action des forces de cisaillement induites par les ultrasons lors de la rupture des micelles de caséine réassemblées.
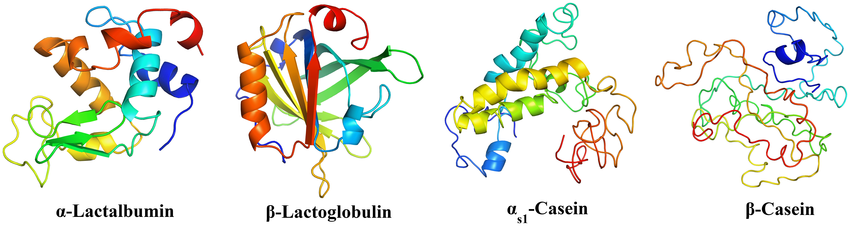
L’effet de la cavitation à flux continu de haute intensité (avec et sans génération de chaleur) sur les protéines de lactosérum (α-lactalbumine [α-La] et β-lactoglobuline [β-Lg]) a montré une dénaturation accrue des protéines par rapport à la chaleur seule lorsqu’elle est combinée à la chaleur ( 61, 70 et 75,5 °C). De plus, une synergie significative entre la cavitation contrôlée et la chaleur a été observée pour la dénaturation de l’α-La et de la β-Lg. La cavitation hydrodynamique pendant 15 minutes a généré la teneur la plus élevée en feuilles β et en SS, tandis qu’un traitement pendant 30 minutes a produit la plus faible activité de dityrosine, de carbonyle et d’antioxydant.
Les données obtenues suggèrent que la cavitation hydrodynamique a le potentiel d’améliorer l’activité antioxydante de la β-Lg. Des observations similaires ont été faites concernant l’activité antioxydante du lait écrémé dans un système d’émulsion de linoléate utilisant l’hémoglobine comme pro-oxydant, entraînant une activité antioxydante accrue du lait écrémé et des fractions de caséine.
Cette augmentation de la capacité antioxydante du lait écrémé pourrait être liée à l’augmentation de la concentration efficace de caséine suite à une éventuelle dégradation de la micelle de caséine induite par les ultrasons.
Divers traitements ont démontré une augmentation progressive de l’hydrophobicité de surface et de la teneur en thiols réactifs de la β-Lg pure, tandis que la protéine α-La était encore plus affectée par la cavitation avec une augmentation significative de l’hydrophobicité de surface.
Il existe de nombreuses applications de la cavitation pour manipuler les caractéristiques des protéines du lait. La cavitation hydrodynamique présente un grand potentiel d’application et peut être utilisée dans des processus continus grâce à sa conception en forme de pompe.
Divers traitements ont montré une augmentation progressive de l’hydrophobie de surface et de la teneur en thiols réactifs de la β-Lg pure, tandis que la protéine α-La était encore plus affectée par la cavitation avec une augmentation significative de l’hydrophobie de surface. Les applications de la cavitation pour manipuler les caractéristiques des protéines du lait sont nombreuses. La cavitation hydrodynamique présente un grand potentiel d’application et peut être utilisée dans des processus continus grâce à sa conception en forme de pompe.